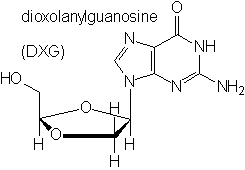Pourquoi la trithérapie a-t-elle
amélioré le pronostic du sida?
![[ image: ]](_249680_mbeki_quote_150.gif) Lorsque,
le 13 mai 2000 j'ai reçu une invitation à signer une pétition de soutien au
Président Sud Africain Thabo Mbeki, je ne m'attendais pas à découvrir que
derrière ce désir de réévaluation de la relation entre le vih et le sida il y
avait une contestation étouffée par 16 ans de "dictature
politico-médiatico-scientifique".
Lorsque,
le 13 mai 2000 j'ai reçu une invitation à signer une pétition de soutien au
Président Sud Africain Thabo Mbeki, je ne m'attendais pas à découvrir que
derrière ce désir de réévaluation de la relation entre le vih et le sida il y
avait une contestation étouffée par 16 ans de "dictature
politico-médiatico-scientifique".
Évidemment, je suis d'abord resté pantois pendant 3 jours, et j'ai ensuite
cherché à vérifier toutes ce informations.
Ce qui m'a beaucoup étonné, et convaincu qu'il y avait quelque chose de pas
net là-dessous, c'est la richesse de l'argumentation des "repenseurs", et en
particulier les nombreuses références données, que j'ai bien entendu essayé de
vérifier, en regard de la pauvreté de celle des officiels, qui généralement
condamnent ex cathedra ces repenseurs, grâce à un argument auquel nombre de
personnes adhèrent, par peur : "en critiquant ainsi le modèle officiel, vous
empêchez les malades de se soigner et donc vous les conduisez à la mort."
Cet argument me rappelle celui des inquisiteurs moyenâgeux.
1. Observations

Un des aspects de la controverse qui m'a le plus interpellé est le rejet
quasi unanime de l'AZT par ces repenseurs. Ayant une formation solide en chimie
organique, j'ai voulu en savoir plus, et je suis tombé des nues en découvrant la
structure de cette molécule : elle présentait un groupement fonctionnel,
l'azoture, dont nous connaissons le devenir in vitro : il libère du diazote, en
présence de certains catalyseurs, et une structure très réactive, le nitrène,
capable de réagir avec énormément de structures biologiques.
Un des documents
les plus complets concernant la toxicité de l'AZT a été compilé par Anthony
Brink, avocat Sud-Africain, et mentor du président Mbeki
D'ailleurs de nombreuses études in vitro et in vivo confirment cette
activité.
Et tout d'abord les études de
Handlon & Oppenheimer en 1988, publiée dans Pharmaceutical Research
(5, 297-299) :
The ability of thiols to reduce 3'-azidothymidine
(AZT) to 3'-aminothymidine has been investigated. Incubation with
glutathione, dithiothreitol (DTT), or mercaptoethanol at pH 7.2 and
37 degrees C leads to quantitative reduction of the azido moiety to
an amine. The reaction is first order in AZT and first order in
reducing agent (mono- or dithiol). The second-order rate constants
are 2.77 x 10(-3), 6.55 x 10(-5), and 6.35 x 10(-6) M-1 sec-1 for
the dithiothreitol, glutathione, and mercaptoethanol reductions,
respectively. The thiol reduction of alkyl azide to amine under mild
conditions is a synthetic method particularly suitable for
water-soluble azido compounds that are sensitive to catalytic
hydrogenation. The potential for the mono- or dithiol-mediated
reduction of alkyl azides under biological conditions must be
considered when conducting studies of azido drugs.
Il est intéressant de noter que dès 1988 on savait que les "remèdes"
comportant un groupement azoture réagissaient sans le secours d'enzymes avec la
principale réserve réductrice du foie et des cellules : le glutathion. Et la
réaction est quantitative in vitro dans les conditions de la cellule vivante.
Pour aller plus loin et voir si d'autres composés se forment dans cette
réaction (qui est bel et bien une réaction d'oxydoréduction, n'en déplaise à
certains biologistes),
Reardon & al. ont réitéré l'expérience en 1994 et ont publié leurs résultats
dans "The Journal of Biological Chemistry (Vol 269 N° 23, pp. 15999-16008)
3'-Azido-3'-deoxythymidine (AZT), AZT
5'-monophosphate, and AZT 5'-triphosphate (AZTTP) were reduced by
dithiothreitol with second-order rate constants of 2.30 x 10(-3),
1.50 x 10(-3), and 7.46 x 10(-4) M-1 s-1, respectively. Handlon and
Oppenheimer reported that AZT is quantitatively reduced by thiols to
3'-amino-3'-deoxythymidine (Handlon, A. L., and Oppenheimer, N. J.
(1988) Pharm. Res. (N.Y.) 5, 297-299). In the present report,
multiple products of this reaction were identified by the techniques
of UV spectroscopy, phosphate analysis, coelution with authentic
standards from reversed-phase high pressure liquid chromatography,
two-dimensional NMR spectroscopy, and mass spectrometry. The product
mixture from reduction of AZT 5'-monophosphate at pH 7.1 and 25
degrees C was composed of 2,3'-anhydro-beta-D-threo-thymidine
5'-monophosphate (6.4%), 3'-amino-3'-deoxythymidine 5'-monophosphate
(19.6%), beta-D-threo-thymidine 5'-monophosphate (6.8%), thymine and
3-amino-2,3-dideoxyribal 5-monophosphate (8.9%),
beta-D-threo-thymidine 3',5'-cyclic monophosphate (9.1%),
3'-deoxy-2',3'-didehydrothymidine 5'-monophosphate (31.5%), and
3',5'-anhydro-beta-D-threo-thymidine (17.8%). Thymine and
3',5'-anhydro-beta-D-threo-thymidine were also products of reduction
of AZT and AZTTP. Furthermore, the nucleosides of the above
monophosphates were products of reduction of AZT, and the
corresponding triphosphates were products of reduction of AZTTP. The
product ratios were dependent on the level of phosphorylation of AZT
and on the pH of the reaction. Mechanisms for formation of these
products are proposed.
Un très grand nombre d'études montre également que l'AZT atteint tous les
éléments du système oxydoréducteur de la cellule :
par exemple
Cretton & al., 1991 ;
Cretton & Sommadossi , 1993 ;
Eagling & al. , 1994 ; etc...
Ce qui est très intéressant dans le document précédent, est que le composé
réduit le plus abondant soit le 3'-deoxy-2',3'-didehydrothymidine 5'-monophosphate,
soit le monophosphate d'un "médicament antisida" bien connu : le d4T. Reardon a
recherché les mécanismes qui conduisent à la formation de tous ces composés. Ce
sont essentiellement des mécanismes de réduction, de substitution et
d'élimination bien connus des organiciens. Rien de bien nouveau sous le soleil
donc, ce qui signifie que ces réactions ont bel et bien lieu in vivo.
D'ailleurs la conclusion de Reardon :
Finally, it has not been demonstrated that
reduction products of AZTMP, AZTDP, or AZTTP are formed
intracellularly. These issues are currently under investigation.
a trouvé solution récemment.
En effet,
Becher et Pruvost ont montré de manière irréfutable cette réduction de l'AZT
en d4T in vivo.
Quoiqu'utilisant les considérations mécanistiques de Reardon (que je
considère comme erronées d'un point de vue strictement chimique), ils montrent
bien qu'un des métabolites de l'AZT (zidovudine) est le d4T (stavudine), et en
tirent des conclusions quant à la mauvaise association AZT-d4T, que tous les
cliniciens rejettent désormais.
Cependant, ils n'élucident pas le mécanisme réel de cette réduction. Qui est
le réducteur, en particulier?
Et, dans leur publication, ils donnent les résultats obtenus chez divers
patients, traités apparemment par un mélange de nucléosides.
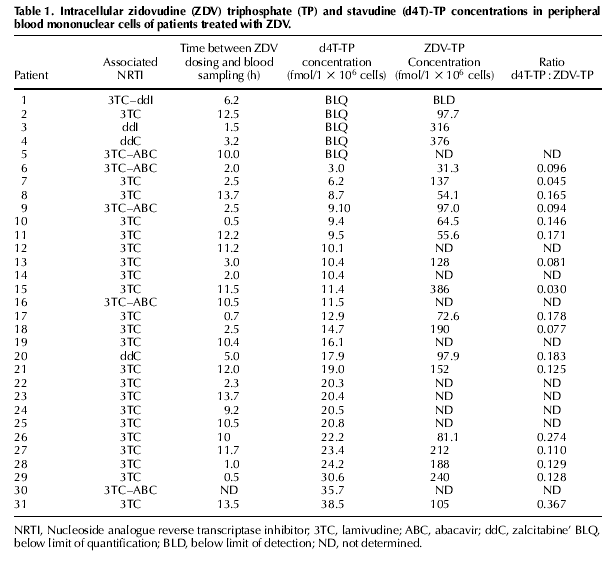
Il est assez clair que la majorité des cas où le d4T est présent
correspondent à la combinaison d'AZT et de 3TC, c'est à dire de 3-thiacytidine.
Appelé encore Lamivudine.
On peut donc se poser raisonnablement la question de savoir si la réduction
de l'AZT, qui est a priori le fait des thiols cellulaires (glutathion), n'est
pas également le fait de la lamivudine. C'est d'ailleurs en étudiant ce tableau
que s'est éclairci pour moi un fait qu'aucun repenseur ne devrait réfuter :
Voici l'évolution des cas de sida aux États-unis de 1980 à nos jours :
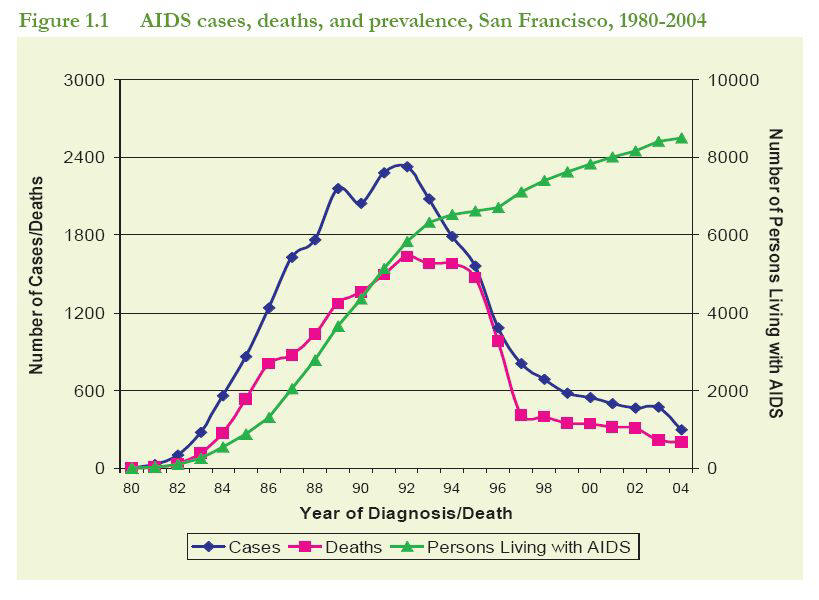
NB : à partir de 1993, on a modifié la définition de la maladie Sida : il
fallait auparavant souffrir d'une maladie opportuniste pour être comptabilisé. A
partir de 1993, pour être considéré comme malade du sida, il fallait être
séropositif et avoir un taux de CD4 inférieur à 200.
Il est clair que le diagnostic du sida véritable a brutalement chuté en
1992-3, chute qui s'est accentuée en 1995-6. De manière encore plus nette, la
mortalité a commencé à chuter en 1996.
Comment interpréter cette évolution, si ce n'est en disant que la trithérapie
a été efficace?
C'est sans tenir compte du fait que les traitements antisida, depuis le début
jusqu'en 1995, ont comporté essentiellement des antibiotiques (par exemple le
bactrim) ou des antifongiques, et surtout l'AZT en 1986-7. Or la montée en
puissance de ces traitements coïncide avec l'augmentation des cas de Sida et
avec celle de la mortalité qui lui est liée. Le retrait de 1992-3 coïncide
exactement avec la diminution du dosage d'AZT dans les régimes médicamenteux,
grâce à l'impact de l'étude
Concorde qui a montré que le fait de retarder l'administration de l'AZT
retardait en fait l'apparition des manifestations morbides, ainsi que la mort.
Par contre, en 1995, apparaît la combinaison AZT-3TC (combivir) qui est
toujours utilisée à ce jour. La plupart des régimes médicamenteux comporteront
désormais ce fameux 3TC.
Il suffit par exemple de se rendre compte de l'engouement qu'il a suscité,
pour comprendre que cet engouement est fortement lié à cette forte diminution de
la mortalité chez les personnes diagnostiques :
3TC
le bon élève de la classe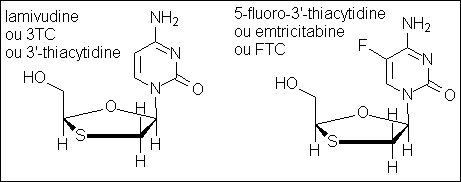
3TC
une synergie pleine de promesse
On constate d'ailleurs que les biologistes ne font que "constater" cette
synergie, sans pouvoir vraiment l'expliquer. C'est pratiquement "mystique".
Un analogue du 3TC, l'emtricitabine ou FTC présente les mêmes avantages, au
point qu'à l'heure actuelle, on ne trouve pratiquement aucune trithérapie sans
3TC ou FTC.
Des études ont été faites pour savoir, parmi les divers analogues de
nucléotides, lesquels ont le plus d'impact sur la santé des malades, et
invariablement, on y retrouve le 3TC ou le FTC.
Par exemple, ce
papier de Saags et Cahn (2004) conclut :
Once-daily emtricitabine appeared to demonstrate greater virological
efficacy, durability of response, and tolerability compared with
twice-daily stavudine when used with once-daily didanosine and
efavirenz.
C'est-à-dire une efficacité virologique incontestable.
Il est tout de même étrange de penser qu'une substance censé fonctionner (emtricitabine)
de la même manière qu'une autre (stavudine) ait un impact tellement différent du
second.
2. Pourquoi cette efficacité?
Tout d'abord, comparons les structures chimiques de tous les
antirétroviraux dont nous venons de parler :
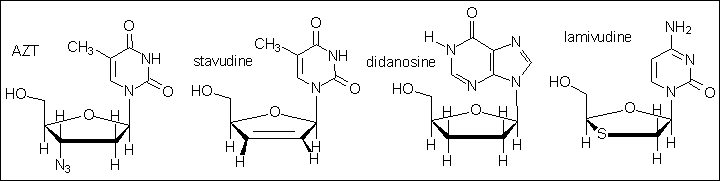
Que constate-t-on? Qu'est-ce qui distingue les nucléosides peu
actifs (stavudine ou didanosine) de la lamivudine?
C'est évidemment la présence de soufre en 3', qui remplace un CH2 ou un CH. Et c'est cela qui change tout, puisqu'on retrouve ce soufre dans l'emtricitabine. De manière plus générale, comme on va pouvoir le constater plus loin, les composés qui vont profondément modifier l'évolution de la maladie sont des acétals ou thioacétals.
Revenons un peu aux effets oxydants de l'AZT et d'autres substances, telles le bactrim ou le métronidazole. Il a été démontré qu'elles réagissaient avec la réserve oxydante des cellules, à savoir le glutathion, dont l'effet antioxydant est lié à un groupement appelé thiol, de structure R-S-H. (tiens, on
retrouve le soufre au même degré d'oxydation).
Or, et c'est très important, la maladie sida
(déficience de CD4 et maladies
opportunistes liées) est aussi intimement liée à une déficience en glutathion. De
Rosa & al. ont bien montré ce lien, et même ont montré que la
supplémentation en thiols biologiques (dérivés de la cystéine) augmentait
l'espérance de vie chez des personnes sous AZT. De
nombreuses études montrent l'importance de ces molécules soufrées : par exemple, celle de Kalebic & Kinter
On y lit par exemple :
At 15mM, GSH, GSE and NAC supressed both HIV production and
total viral protein synthesis
Il est piquant de constater que les auteurs indiquent aussi que la
combinaison de ces thiols avec l'AZT a un effet antiviral "coopératif" . Un peu
comme l'effet synergique du 3TC!
Par ailleurs, la présence de vih a été déterminée par l'activité de la
rétrotranscriptase, méthode qui selon Papadopoulos & al. ne suffit pas pour
démontrer la présence d'un virus, mais permet de montrer l'existence d'un stress
oxydatif.
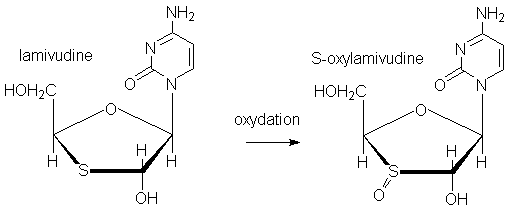
3. Comment peut-on comparer chimiquement le 3TC aux thiols?
En ce qui concerne les propriétés oxydoréductrices, la lamivudine est un
réducteur cellulaire (comme l'est le glutathion).
La preuve en est que le principal métabolite excrété est la S-oxy-lamivudine
RXLIST
nous fournit quelques explications :
Metabolism of lamivudine is a minor route of elimination. In man,
the only known metabolite of lamivudine is the trans-sulfoxide
metabolite. Within 12 hours after a single oral dose of lamivudine
in 6 HIV-infected adults, 5.2% ± 1.4% (mean ± SD) of the dose was
excreted as the trans-sulfoxide metabolite in the urine. Serum
concentrations of this metabolite have not been determined
Cependant, le chimiste un peu exercé constatera que cette
structure représente un 3-oxathiolane, c'est à dire un acétal semisoufré. Ces
composés peuvent être synthétisés en l'absence d'eau (conditions anhydres) et
sont stables dans l'eau à pH > 6 environ. Par contre, ils sont hydrolysés plus
ou moins rapidement à pH acide.
Le site Organic-chemistry.org nous permet d'aller un peu plus loin.
En effet, la structure de la lamivudine est intermédiaire entre celle d'un
dithiolane et celle d'un
dioxolane. Nous avons un grand nombre d'informations sur ce site.
En particulier, nous constatons que les premiers sont les plus difficiles à
hydrolyser à pH =1 (soit le pH stomacal). Logiquement, la lamivudine sera au
moins aussi rapidement hydrolysée que les dithiolanes. Or que constate-t-on?
hydrolysée que les dithiolanes. Or que constate-t-on?
(NB : la légende est trouvée
ici : )
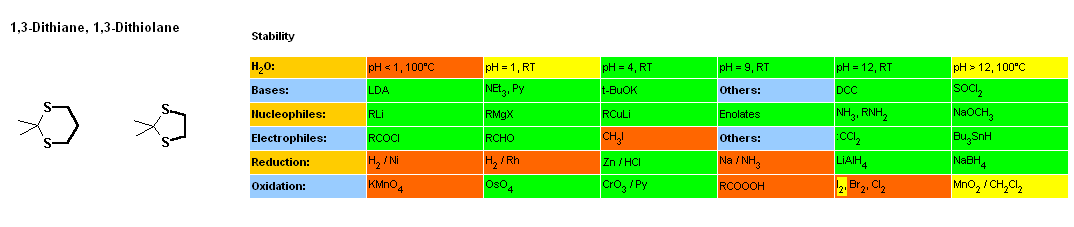
A pH=1 et à température ordinaire, les dithiolanes réagissent lentement (voir
les quelques réactions de déprotection qui donnent une durée de 1 à 4h selon la
proportion d'eau). Durée suffisante pour que dans l'estomac, une quantité
conséquente de lamivudine soit hydrolysée :
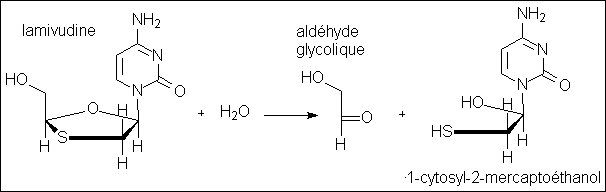
Il se forme un aldéhyde, l'aldéhyde glycolique et un mercaptoalcool. Ce dernier (1-cytosyl-2-mercaptoéthanol) est d'ailleurs théoriquement instable et se transformerait en cytosine et en 2-mercaptoéthanal HS-CH2-CHO. Cette hydrolyse est par ailleurs fortement catalysée par les électrophiles, ainsi que l'indiquent Carey et Sundberg, en particulier l'ion nitrosyle +NO, très présent chez les patients souffrant de stress oxydatif
Le 1-cytosyl-2-mercaptoéthanol et le 2-mercaptoéthanal sont tous deux des thiols, et ce dernier un aldéhyde, et sont donc susceptibles de remplacer partiellement les thiols déficients, ou plutôt, selon moi, d'éviter l'oxydation du glutathion en sulfates par l'AZT. Noter aussi, dans cette optique que les dithiolanes sont oxydés rapidement par le dibrome, ( potentiel rédox du couple Br2/Br - = 1,09 V), alors que le couple HN3/(NH4+ + N2) [structures proches de l'AZT] a un potentiel redox nettement supérieur égal à 1,96V (valeurs données dans l"Usuel de chimie générale et minérale" de Maurice Bernard & Florent Busnot [Dunod])
Par ailleurs les aldéhydes sont très réducteurs (plus réducteurs que les thiols), puisque le potentiel redox du couple acide/aldéhyde est de 0,09 V, celui du couple RSSR/2 RSH étant de 0,3 V environ.
D'ailleurs quelques études tendent à prouver que cette hypothèse n'est pas à négliger.
Et en particulier, cette
étude de Fletcher & al.
First, zidovudine has been shown in vitro
to reduce the amount of lamivudine triphosphate formed in
phytohemagglutinin-stimulated PBMC and U937 cells. We hypothesize
that the probable mechanism of this inhibition is the ability of
zidovudine to increase dCTP pools in stimulated and resting cells,
which results in feedback inhibition of deoxycytidine kinase
activity
Manifestement, l'AZT diminue le taux de lamivudine in vitro. Le simple bon
sens serait de rechercher une réaction possible entre les deux. Et
effectivement, nous venons de montrer cette possibilité évidente, l'un étant
réducteur (la lamivudine), l'autre oxydant (l'AZT).
Et l'on peut prévoir la formation de stavudine et de sulfates, stade ultime
de l'oxydation des composés soufrés. Ces sulfates sont d'ailleurs connus pour
être générateurs de fortes diarrhées.
Mais les biologistes sont compliqués, et "hypothétisent" que l'AZT augmente
le taux de nucléotides contenant de la cytosine,...
4. Autres études mettant en jeu des acétals ou des thiocétals
Une première étude, récente (1999), apporte de l'eau au moulin de cette hypothèse:
- "Anti-Human Immunodeficiency Virus Type 1 Activity, Intracellular Metabolism, and Pharmacokinetic Evaluation of 2'-Deoxy-3'-Oxa-4'-Thiocytidine" -
De Muys, Gurdeau, Nguyen-Ba
Antimicrobial Agents and Chemotherapy, August 1999, p. 1835-1844, Vol. 43, No. 8 0066-4804/99
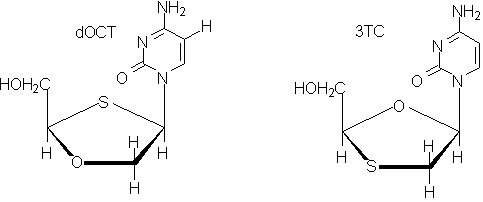
Il y est clairement indiqué que l'impact virologique du dOCT est plus important que celui du 3TC, et pourtant, la taux de dOTC non métabolisé est bien moindre que celui du 3TC : avec moins de "substance" dans la cellule, il y a un effet pharmacodynamique plus important. L'article ne précise pas la nature des métabolites formés, de masse molaire clairement plus faible que celle du dOTC puisque leur temps de rétention en CPG est plus faible, mais il n'est pas interdit de penser que c'est leur présence qui va donner plus d'efficacité au dOTC. Un de ces métabolites pourrait être par exemple le 2-cytosyl-2-mercaptoéthanol, un thiol très certainement réducteur, qui serait obtenu beaucoup plus facilement à partir du dOTC que ne le peut être le 1-cytosyl-2-mercaptoéthanol à partir du 3TC, sans doute parce que l'hydrolyse commence par la protonation de l'oxygène, plus facile dans le dOTC où cet oxygène est moins encombré.
Bien entendu, la présence de ce métabolite induit celle d'aldéhyde glycolique.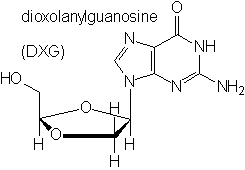
Un autre article de 1999, provenant également du laboratoire de Mark Wainberg, étudie l'impact des dioxolanes correspondants. Il constate que ceux-ci sont capables d'opérer là où les autres nucléosides de synthèse ont échoué à cause de diverses "mutations".
Cependant, la réactivité vis-à-vis de l'eau des dioxolanes, telle qu'indiquée ici, est extrêmement importante, au point que même à pH=4, ils sont lentement hydrolysés. A pH=1, l'hydrolyse se fait en 5 minutes.
Comment peut-on expliquer son impact positif vis-à-vis du Sida, alors que l'hydrolyse ne libère pas de thiols ici?
La seule hypothèse plausible tient compte du fait que dans tous les cas dont nous venons de parler (dioxolanes, oxathiolanes, voire dithiolanes), il y a libération d'aldéhyde glycolique HOCH2-CHO. La vitesse de cette libération dépend de la vitesse d'hydrolyse de l'hétérocycle. Celle-ci varie de la manière suivante :
dioxolane > oxathiolane substitué à proximité du soufre > oxathiolane substitué à proximité de l'oxygène > dithiolane.
Nous constatons que c'est en gros l'évolution de l'impact positif de ces molécules sur les facteurs "virologiques".
Il a d'ailleurs été montré sans ambiguïté que les monooxygénases dépendant du cytochrome P450 oxydent l'aldéhyde formé in vitro. Par ailleurs, l'aldéhyde oxydase est capable de réduire de nombreux oxydants azotés, ainsi que le montre cette étude :
Aldehyde oxidase is a molybdenum cofactor-containing soluble enzyme present in the liver and other tissues of several mammalian species. Despite its name, aldehyde oxidase is involved not only in the oxidation of aldehydes to carboxylic acids but also in the oxidation of nitrogen-containing heterocyclic compounds and the reduction of nitro-aromatic compounds, isoxazole, and isothiazole ring systems.... Compared to the cytochrome P450 system, this offers a much simpler situation in which to address potential drug interactions using in vitro approaches.
On conçoit ici que un composé qui libère un aldéhyde soit capable, grâce à l'aldéhyde oxydase, d'éliminer le danger provenant des dérivés nitrés aromatiques (métronidazole par exemple) ou des isoxazoles (bactrim)
Le caractère réducteur de ces dérivés comportant des cycles à 2 hétéroatomes chalcogènes (oxygène, soufre, voire sélénium) est donc amplement démontré, et proviendrait essentiellement de la fonction aldéhyde libérée et accessoirement de la formation de thiols.
5. Conclusion
D'autres études sont bien sûr nécessaires, mais il semble tout à fait
raisonnable d'envisager, sous l'angle du stress oxydatif cher au
groupe de Perth et à
Heinrich Kremer (voir
"Réponses au Président Mbeki"), que la lamivudine et les autres
acétals capables de libérer un aldéhyde supprime en grande partie les effets oxydants de l'AZT, et l'empêche de faire disparaître la réserve
réductrice cellulaire, déjà bien entamée par la maladie sida elle-même.
On peut même se demander si finalement la forte mortalité attribuée au sida
(ou plutôt au vih) à la fin des années 80 n'est pas due essentiellement à
l'absorption excessive d'AZT.
Cheminot
![[ image: ]](_249680_mbeki_quote_150.gif) Lorsque,
le 13 mai 2000 j'ai reçu une invitation à signer une pétition de soutien au
Président Sud Africain Thabo Mbeki, je ne m'attendais pas à découvrir que
derrière ce désir de réévaluation de la relation entre le vih et le sida il y
avait une contestation étouffée par 16 ans de "dictature
politico-médiatico-scientifique".
Lorsque,
le 13 mai 2000 j'ai reçu une invitation à signer une pétition de soutien au
Président Sud Africain Thabo Mbeki, je ne m'attendais pas à découvrir que
derrière ce désir de réévaluation de la relation entre le vih et le sida il y
avait une contestation étouffée par 16 ans de "dictature
politico-médiatico-scientifique".





 hydrolysée que les dithiolanes. Or que constate-t-on?
hydrolysée que les dithiolanes. Or que constate-t-on?